(来源:药明康德)
转自:药明康德
编者按:2025年,药明康德迎来创立25周年的重要里程碑。值此契机,我们向所有与我们共同书写产业变革篇章的科学家、医药人和投资者致以衷心感谢与诚挚敬意,也特别推出“致敬时代”系列,回顾全球同仁如何借助科学与合作的力量,不断拓展治疗边界、改善患者命运。
四分之一个世纪的坚守,只为加速每一款新药的诞生。下一个25年,我们将继续心怀感恩与敬畏,依托独特的CRDMO模式,与全球伙伴携手同行,共赴健康未来。
急性髓系白血病(AML)是成年人中最常见的白血病类型之一,多发于60岁及以上的人群,但也可能累及年轻人和儿童。据流行病学统计,2021年全球新发AML病例数超14万例。AML病情发展迅猛,如果不及时接受治疗,患者可能在几周到几个月内就发展为重症并死亡。
面对这一高危疾病,AML的治疗策略近年来取得显著进展。除传统化疗、放疗及造血干细胞移植外,靶向药物、免疫疗法、细胞治疗及抗体偶联药物(ADC)等新型治疗方式逐步应用于临床,推动疗效不断提升。数据显示,过去几十年间,AML患者的5年生存率已从1975年的5.4%提升至2017年的33.7%,增长近6倍。在推动AML治疗革新的进程中,药明康德依托25年的行业深耕,不仅见证了AML治疗药物从实验室走向临床转化应用的突破历程,同时凭借其独特的CRDMO业务模式,助力全球合作伙伴加速包括AML在内的多种疾病创新疗法的研发进程,为全球患者带来更多治愈希望。
从“脓血”疑云到解密白血病细胞的200年之路
AML的认知经历了两个世纪的探索。19世纪初,医学文献中已零星记载了一类血液异常病例:患者常伴发热、虚弱、肝脾肿大,血液外观呈乳糜状或脓血样。当时虽未精准归类,但这些现象已提示存在一种独特血液疾病。
1845年,显微镜技术带来了关键突破。英国医生约翰·休斯·贝内特(JohnHughesBennett)报道了首例白血病病例:一名28岁男性患者脾肝显著肿大,血管内充斥乳白色脓液样物质。显微镜下,他观察到患者血液中布满无色球体(白细胞),与凝固的纤维蛋白丝交织,并由此提出“白血球增多症(leucocythemia)”的概念,首次明确该病为原发性全身性血液疾病,而非感染引发的继发表现。
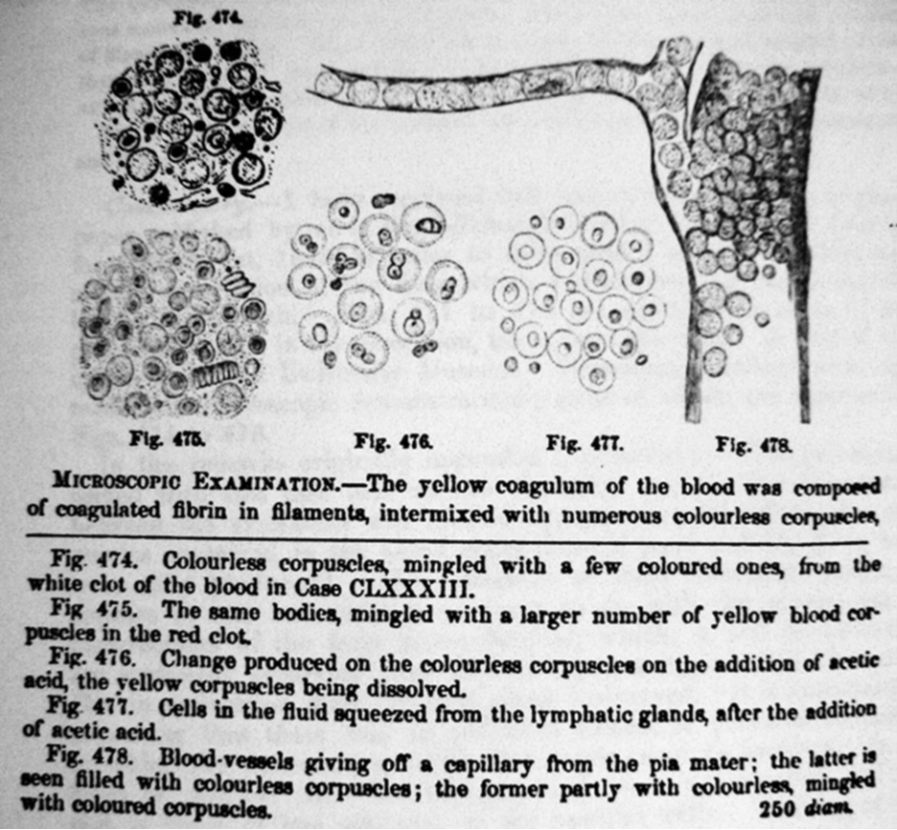 ▲贝内特所绘制的白血病患者血液中的无色球体(图片来源:参考资料[7])
▲贝内特所绘制的白血病患者血液中的无色球体(图片来源:参考资料[7])贝内特的研究迅速引发学界关注。同年,德国病理学家鲁道夫·菲尔绍(RudolfVirchow)也报道了类似病例。他通过系统分析发现,患者体内白细胞异常增殖会抑制红细胞生成,进而指出:白细胞增多是疾病的本质特征,而非脓液形成所致。1847年,菲尔绍正式将这类疾病命名为“白血病(leukämie)”,并尝试将其分为脾源性和淋巴性两大类——虽然这一分类尚不精确,却为现代白血病分型奠定了基础。
19世纪下半叶,随着病例积累,白血病逐渐被确认为独立疾病实体,临床与病理学研究的深入,也为探索其本质创造了条件。
1870年代,德国医学家保罗·埃利希(PaulEhrlich)改进了血细胞染色技术,使血细胞结构清晰可见,进而首次识别出“原始细胞”——即未成熟的血细胞前体(现代医学中的造血干细胞)。埃利希还提出根据病程快慢和细胞成熟度,将白血病分为急性、慢性两大类:急性白血病以未成熟原始细胞大量增殖、病情进展迅速为特征;慢性白血病则由相对成熟但功能异常的细胞增殖主导,进展缓慢。这一分类框架逐步演化为现代白血病四大亚型:AML、急性淋巴细胞白血病(ALL)、慢性髓系白血病(CML)和慢性淋巴细胞白血病(CLL)。
从19世纪对“脓血”现象的误解,到埃利希时代对白血病细胞分化特征的精准界定,人类对AML的认识已从宏观深入微观。这些历史积累不仅奠定了现代血液学的基础,更为后续AML分子机制研究与靶向治疗的开发提供了不可或缺的科学前提。
化疗筑基,靶向疗法为特殊患者群体破局
数十年来,AML的治疗策略经历了从传统化疗到精准靶向治疗的演进。以阿糖胞苷联合蒽环类药物(如柔红霉素或去甲氧柔红霉素、伊达比星)的“7+3方案”为代表的强化诱导化疗,曾长期作为年轻、体健且携带良好风险特征AML患者的基础治疗方案,使部分患者获得长期缓解。然而,AML多发于老年人群,多数患者年龄超过65岁,常因合并症、高危遗传学异常及对强化化疗耐受差等因素,临床预后不佳。针对不适合强化化疗的患者,去甲基化药物如阿扎胞苷的应用显著改善了患者的生存结局。
时至今日,传统化疗药物仍构成AML治疗的重要支撑,除“7+3”方案常用药物外,还包括克拉屈滨、氟达拉滨、米托蒽醌、依托泊苷、羟基脲、皮质类固醇(如泼尼松或地塞米松)、甲氨蝶呤、6-巯基嘌呤(6-MP)、地西他滨。随着脂质体递送系统的进步,复方制剂如Vyxeos(柔红霉素/阿糖胞苷脂质体)也进一步优化了传统AML治疗药物的治疗指数。
 图片来源:123RF
图片来源:123RF近年来,针对癌细胞特定分子组分的靶向药物迅速发展,显著改变了AML的治疗格局。靶向药物通过特异性抑制白血病细胞的异常信号通路或分子标志,不仅为复发/难治性AML提供了新选择,也逐渐进入一线治疗,为老年及不耐受化疗的脆弱患者群体带来了希望。
从4000个化合物中筛出的希望,开启AML靶向治疗新篇
在众多分子靶点中,FLT3基因突变尤为关键。FLT3是一种受体酪氨酸激酶,调控造血干细胞的增殖、分化与存活。其突变可促进白血病细胞无限增殖并抑制凋亡,特别是FLT3-ITD突变,与AML预后不良密切相关。随着机制研究的深入,FLT3被确立为AML治疗的重要靶点。
FLT3抑制剂的研发起步于约翰斯·霍普金斯大学唐纳德·斯莫尔(DonaldSmall)博士团队。上世纪90年代,斯莫尔博士克隆出了首个人类FLT3基因并揭示了其在AML中的致病作用。由于当时缺乏高通量筛选工具,研究团队利用96孔板手动筛选了4000余种化合物,最终发现CEP-701(lestaurtinib)为潜在FLT3抑制剂。随后,通过实验室和动物模型验证,并构建FLT3活性检测方法,研究人员进一步明确了其作用机制。临床研究显示,CEP-701可清除AML患者外周血中的白血病细胞,在部分患者体内甚至还能清除白血病细胞的发源地——骨髓中的白血病细胞。但这种疗效是暂时的,且存在药物与血浆蛋白结合过强等缺陷,最终限制了其应用。
基于斯莫尔博士团队的发现以及其他研究成果,新一代的FLT3抑制剂逐步克服了这些局限性。数年后,研究者意外发现多激酶抑制剂Rydapt(midostaurin,米哚妥林)竟是一种强效FLT3抑制剂。该药物最初作为PKC抑制剂开发,在实体瘤模型中展现出抗增殖活性。体外实验表明,米哚妥林可在极低浓度下抑制FLT3-ITD阳性小鼠原B细胞株增殖,并通过诱导凋亡和阻滞细胞周期发挥作用。在动物模型中,其口服治疗显著改善了移植FLT3-ITD骨髓小鼠(模拟AML模型)的生存。由于该药物的安全剂量已在其他疾病患者中确立,研究人员迅速将其应用于AML临床试验。
在早期单药研究中,米哚妥林虽能降低外周血原始细胞计数,但完全缓解率有限,引发了对其疗效的质疑。然而,联合治疗方案改变了这一局面:米哚妥林与标准化疗联合使用,显著提高了AML患者的治疗结局。最终,2017年,美国FDA批准米哚妥林联合标准阿糖胞苷+柔红霉素诱导治疗及阿糖胞苷巩固治疗,用于FLT3突变阳性的成人AML患者。
 图片来源:123RF
图片来源:123RF米哚妥林的成功标志着AML靶向治疗的开端,也推动了更多高效、选择性更强的FLT3抑制剂相继问世。其中,Xospata(gilteritinib,吉瑞替尼)于2018年获FDA批准,用于复发/难治性FLT3突变AML;2023年,Vanflyta(quizartinib)也获得FDA批准,可联合化疗用于新确诊FLT3-ITD阳性AML成人患者,并在巩固化疗后可作为维持治疗单药使用。
不杀死癌细胞也能治病的抗癌药
在AML研究的另一条路径上,科学家的目光逐渐转向了癌细胞代谢。2009年,基因测序揭示了一个意外的发现:异柠檬酸脱氢酶(IDH)基因在部分AML患者中发生突变。最初,这一结果让研究者颇感困惑,毕竟,IDH是糖代谢和三羧酸循环中的关键酶,长期以来并未被视为典型的癌基因。
然而,深入研究揭示了谜底。IDH突变改变了细胞代谢的走向:原本应生成α-酮戊二酸(a-KG)的反应被打断,反而触发了其“逆向反应”,产生异常代谢物2-羟基戊二酸(2-HG)。2-HG的大量积累抑制了a-KG依赖性酶的活性,导致DNA甲基化紊乱和基因表达失调,由此使癌基因被激活、抑癌基因沉默。更为重要的是,这一代谢异常阻碍了造血细胞的正常分化,迫使其停留在“幼稚”的状态,从而推动白血病的发生与进展。研究者同时发现,在星形细胞瘤、胶质母细胞瘤等多种肿瘤中也存在IDH1/2突变,凸显了其在肿瘤发生中的普遍性作用,高水平的2-HG更是与AML的不良预后相关。
由此,一个全新的治疗设想浮现:如果能够抑制突变IDH的功能,让分化阻滞解除,使白血病细胞重新分化为成熟血细胞,疾病或许就能被逆转。这一理念不同于“直接杀死癌细胞”的传统模式,而是采用了“诱导分化”的全新思路。
带着这一希望,医药界纷纷针对IDH靶点开展研发工作。经过多年探索,IDH2抑制剂Idhifa(enasidenib)率先问世,并于2017年获得FDA批准,用于治疗IDH2突变的复发/难治性AML。随后,IDH1抑制剂Tibsovo(ivosidenib,艾伏尼布)在2018年被FDA批准用于IDH1突变的复发/难治性AML;2019年,其适应症扩展至一线治疗——适用于≥75岁或因合并症无法耐受强化化疗的AML患者。2022年,FDA进一步批准艾伏尼布联合阿扎胞苷用于高龄(≥75岁)或其他不适合强化治疗的新确诊AML患者,显著拓宽了受益人群。同年,Rezlidhia(olutasidenib)也获FDA批准用于治疗IDH1突变的复发/难治性AML,为患者提供了更多选择。
与依赖强烈细胞毒性的传统化疗不同,IDH抑制剂的作用机理别具一格:它们并不是直接摧毁癌细胞,而是通过解除分化阻滞,让“迷途”的白血病细胞回归正常发育轨迹,重新成为成熟的血细胞。这种“以分化代替杀伤”的新理念,为更多AML患者带来了与癌症长期共存甚至逆转疾病的希望。
多靶点突破,AML治疗百花齐放
随着靶向治疗的不断进展,AML治疗领域中多个关键靶点逐渐被开发,CD33、BCL-2、Hedgehog信号通路以及menin等靶点相继迎来突破性药物,持续推动AML治疗模式的革新。
在CD33靶向药物方面,目前已获批的药物包括Mylotarg(gemtuzumabozogamicin),其于2017年获美国FDA批准,用于新确诊的CD33阳性AML成人患者,以及2岁及以上的复发/难治性CD33阳性AML儿童和成人患者。
BCL-2抑制剂中,已有Venclexta(venetoclax,维奈克拉)获批上市。该药物于2018年获美国FDA加速批准,与阿扎胞苷/地西他滨或低剂量阿糖胞苷联合,用于≥75岁或因合并症无法接受强化化疗的AML患者一线治疗。
在Hedgehog信号通路抑制剂方面,Daurismo(glasdegib)于2018年获FDA批准,可联合低剂量阿糖胞苷用于≥75岁或因合并症不适合强化化疗的新确诊AML成人患者,进一步拓宽了化疗不耐受人群的治疗选择。
 图片来源:123RF
图片来源:123RFMenin抑制剂及DNA去甲基化药物组合也取得重要进展:2024年11月,美国FDA批准menin抑制剂Revuforj(revumenib)上市,用于治疗成人及≥1岁儿童中携带KMT2A易位的复发/难治性急性白血病患者;2023年,欧盟委员会批准Inaqovi(地西他滨+cedazuridine),用于新确诊且不适合标准诱导化疗的AML成人患者,目前美国FDA已受理该药物与维奈克拉联合治疗同类患者的申请,预计将于2026年2月做出决定。
在生物制品领域,已有多款药物用于AML辅助治疗:重组人粒细胞集落刺激因子Neutrogin(lenograstim)、Neupogen(filgrastim)在日本获批,用于缩短AML患者化疗后中性粒细胞恢复时间及发热持续时间;氨肽酶N(APN)抑制剂Bestatin(ubenimex,乌苯美司)上世纪80年代在日本获批用于AML维持治疗;硫鸟嘌呤(tabloid/tioguanine)早在上世纪60年代就获美国FDA批准,用于AML缓解诱导及巩固治疗;Ceplene(histaminedihydrochloride)在2008年获EMA批准,与IL-2联合用于首次缓解期AML成人患者的维持治疗。
一体化CRDMO为AML患者带来曙光
过去25年间,靶向疗法、免疫疗法和细胞疗法等创新治疗模式的不断涌现,持续重塑着血液癌症的治疗格局,让越来越多患者在延长生命的同时获得更好的生活质量。而这些疗法突破的背后,离不开科研人员对医学前沿的执着探索,以及产业伙伴间高效协同的支撑。长期以来,药明康德始终凭借“一体化、端到端”的CRDMO平台,持续赋能合作伙伴在血液癌症新药研发中不断突破,加速创新成果落地,惠及全球患者。
在AML治疗领域,过去25年间,全球监管机构已先后批准了数十款AML创新疗法,为长期面临治疗困境的AML患者带来了新的治疗希望。作为创新的赋能者,药明康德很高兴能为其中多款疗法提供赋能,助力合作伙伴将这些创新疗法带到全球患者身边。在25年发展历程中,药明康德始终致力于支持全球合作伙伴从药物研究发现(R)、开发(D)到商业化生产(M)各个阶段的需求,助力突破性疗法加速研发进程。
以血液肿瘤的小分子药物为例,药明康德化学服务平台能支持各种化学药物的分子形式及类别,满足从药物发现到商业化生产各个阶段、各个规模的各种物料需求。药明康德生物学业务平台作为综合性的早期发现和转化生物学赋能平台,能为包括血液肿瘤在内的多个疾病领域的新药研发提供从早期发现到临床研究阶段的生物学解决方案。药明康德测试业务平台可为包括血液肿瘤在内多个疾病领域的药物提供全生命周期的一体化研发测试服务及全方位的临床研究服务,助力合作伙伴的药物成功申报IND、NDA以及通过核查上市。
随着对血液肿瘤发病机制理解的持续深化和治疗技术的不断创新,全球血液肿瘤药物研发正迈向更加精准、高效的新阶段。展望未来,药明康德将继续秉承“让天下没有难做的药,难治的病”的愿景,助力合作伙伴加速更多好药新药问世。
参考资料:
[1]Acutemyelogenousleukemia,Retrievedseptember9,2025fromhttps://www.mayoclinic.org/diseases-conditions/acute-myelogenous-leukemia/symptoms-causes/syc-20369109
[2]AcuteMyeloidLeukemiaTreatment(PDQ®)–PatientVersion,Retrievedseptember9,2025fromhttps://www.cancer.gov/types/leukemia/patient/adult-aml-treatment-pdq
[3]Acutemyeloidleukaemia,Retrievedseptember9,2025fromhttps://www.nhsinform.scot/illnesses-and-conditions/cancer/cancer-types-in-adults/acute-myeloid-leukaemia
[4]AcuteMyeloidLeukemia(AML),Retrievedseptember9,2025fromhttps://my.clevelandclinic.org/health/diseases/6212-acute-myeloid-leukemia-aml
[5]KeyStatisticsforAcuteMyeloidLeukemia(AML).Retrievedseptember9,2025fromhttps://www.cancer.org/cancer/types/acute-myeloid-leukemia/about/key-statistics.html#:~:text=About%2022%2C010%20people%20will%20be,is%20about%20%C2%BD%20of%201%25.
[6]ThomasX.Firstcontributorsinthehistoryofleukemia.WorldJHematol2013;2(3):62-70[DOI:10.5315/wjh.v2.i3.62]
[7]Kampen,KimR.“Thediscoveryandearlyunderstandingofleukemia.”Leukemiaresearchvol.36,1(2012):6-13.doi:10.1016/j.leukres.2011.09.028
[8]Strebhardt,K.,Ullrich,A.PaulEhrlich/'smagicbulletconcept:100yearsofprogress.NatRevCancer8,473–480(2008).https://doi.org/10.1038/nrc2394
[9]TheHistoryofLeukemia.Retrievedseptember9,2025fromhttps://bloodcancerunited.org/resources/blog/history-leukemia#early-leukemia-discoveries
[10]BlumS,BacherU,PabstT.TheEvolvingTreatmentLandscapeofAML.healthbookTIMESOncoHema.2022;11(1):32-41.doi:10.36000//hbT.OH.2022.11.065
[11]TargetedTherapyDrugsforAcuteMyeloidLeukemia(AML),Retrievedseptember9,2025fromhttps://www.cancer.org/cancer/types/acute-myeloid-leukemia/treating/targeted-therapy.html
[12]FLT3Inhibitors.Retrievedseptember9,2025fromhttps://www.hopkinsmedicine.org/news/articles/2018/05/flt3-inhibitors#:~:text=Pediatric%20Oncology%20Director%20and%20leukemia,laborious%2C%20time%2Dconsuming%20process.
[13]Stone,RichardMetal.“Midostaurin:itsodysseyfromdiscoverytoapprovalfortreatingacutemyeloidleukemiaandadvancedsystemicmastocytosis.”Bloodadvancesvol.2,4(2018):444-453.doi:10.1182/bloodadvances.2017011080
[14]Acharya,Bakuetal.“FLT3inhibitorsforacutemyeloidleukemia:successes,defeats,andemergingparadigms.”RSCmedicinalchemistryvol.13,7798-816.23May.2022,doi:10.1039/d2md00067a
[15]Daver,N.,Schlenk,R.F.,Russell,N.H.etal.TargetingFLT3mutationsinAML:reviewofcurrentknowledgeandevidence.Leukemia33,299–312(2019).https://doi.org/10.1038/s41375-018-0357-9
[16]Chowdhury,Rasheduzzamanetal.“Theoncometabolite2-hydroxyglutarateinhibitshistonelysinedemethylases.”EMBOreportsvol.12,5(2011):463-9.doi:10.1038/embor.2011.43
[17]Sun,X.-J.;Chen,Z.;Chen,S.-J.MutationsinDNAMethyltransferasesandDemethylases.InEncyclopediaofCancer,3rded.;Boffetta,P.,Hainaut,P.,Eds.;AcademicPress:Cambridge,MA,USA,2019;pp.528–537.
[18]Mardis,ElaineRetal.“Recurringmutationsfoundbysequencinganacutemyeloidleukemiagenome.”TheNewEnglandjournalofmedicinevol.361,11(2009):1058-66.doi:10.1056/NEJMoa0903840
[19]Issa,GhayasC,andCourtneyDDiNardo.“AcutemyeloidleukemiawithIDH1andIDH2mutations:2021treatmentalgorithm.”Bloodcancerjournalvol.11,6107.3Jun.2021,doi:10.1038/s41408-021-00497-1
[20]Yun,Zhangjun,etal./"Global,RegionalandNationalBurdenofLeukemia,1990-2021:AnalysisofDatafromtheGlobalBurdenofDiseaseStudy2021./"Blood144(2024):7907.
 海量资讯、精准解读,尽在新浪财经APP
海量资讯、精准解读,尽在新浪财经APP 编辑: 来源:
